Update zu Roche 2024
Update zur Roche-Studie
Kritik an mangelnder Beschreibung der Nebenwirkungen des Medikaments Tominersen
Der Vorstand der DHH und der medizinische Beirat Dr. Marquard verfassten einen Brief an Roche mit der Bitte um Aufklärung bezüglich nicht zuvor genannter Nebenwirkungen des Medikaments Tominersen. Schließlich forderte die Ethikkommission der Universität Ulm eine Ergänzung der Probandenaufklärung bis zum 13. März 2024, welche von Roche umgesetzt wurde.
Was ist über die abgebrochene Studie GENERATION-HD1 aktuell bekannt und von Roche Pharma AG veröffentlicht?
Die Studie musste abgebrochen werden, da festgestellt wurde, dass sich bei einer Verabreichung von 120 mg alle acht Wochen die Funktionsfähigkeit (gemessen mit der Total Functional Capacity) der Patient*innen im Vergleich zum Placebo verschlechterte. Bei Gabe alle 16 Wochen war kein Unterschied zum Placebo erkennbar.
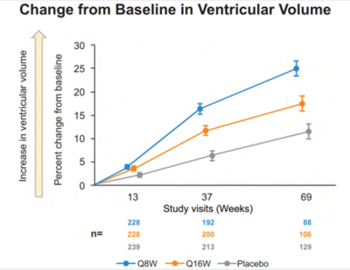
Darüber hinaus ergaben weitere Analysen, dass sich die inneren Hirnkammern, auch als Ventrikel bezeichnet, im MRT messbar vergrößert hatten.
Das Ventrikelsystem besteht aus vier miteinander verbundenen Hirnkammern, den sogenannten Ventrikeln, und ist für die Zirkulation des Hirnwassers verantwortlich. Dieses versorgt das Gehirn mit Nährstoffen und ist für den Abtransport von Stoffwechselprodukten zuständig.
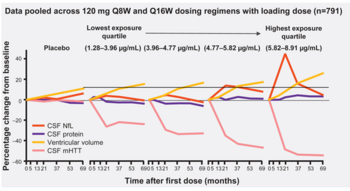
Diese Erweiterung der Ventrikel zeigte sich bei allen Patientengruppen, die mit RG6042 (Tominersen) behandelt wurden, einschließlich der Gruppe mit dem geringsten Wirkspiegel im Nervenwasser (Exposition), wie die 2. Abbildung (orangene Linie) zeigt.
Schon im Februar 2023 hat sich Jochen Maier in seiner Funktion als stellvertretender Vorsitzender der DHH und Patientenvertreter im gemeinsamen Bundesausschuss (GBA) im Namen der DHH bemüht, von der Firma Roche zu erfahren, wie potenzielle Teilnehmer an der Studie GENERATION-HD2 von Roche über bekannte Nebenwirkungen von RG6042 (Tominersen) aufgeklärt werden. Leider blieben diese Bemühungen erfolglos. Auskünfte wurden unter Verweis auf die Vertraulichkeit der Daten verweigert.
Aufgrund dieser Befunde in den Schaubildern und die nach Meinung des Vorstandes der DHH unzureichende Information potenzieller Teilnehmer wurde der Wissenschaftliche Beirat der DHH auf diese Missstände aufmerksam gemacht. Daraufhin fand am 08. Januar 2024 eine Online-Sitzung des Wissenschaftlichen Beirats der DHH, an dem 10 Wissenschaftler teilnahmen. Übereinstimmung bestand hinsichtlich der Unzulänglichkeit der Information potenzieller Teilnehmer. Es wurde beschlossen, unter Federführung von Prof. Dr. Saft und Dr. Reilmann einen Brief an die Firma Roche zu verfassen, um eine bessere Aufklärung potenzieller Teilnehmer zu erreichen. Da bis Ende Januar 2024 kein Schreiben an die Firma Roche gesendet worden war, haben mit Zustimmung von sieben Beiräten der Deutschen Huntington-Hilfe (zwei Enthaltungen, von den übrigen keine Antwort) der Vorstand der DHH und Dr. Marquard eine E-Mail an die Ethikkommission der Universität Ulm und an das BfArM geschickt und um Nachbesserung der Aufklärung gebeten.
Während das BfArM sich nicht für zuständig erklärte, nahm die Ethikkommission der Universität Ulm die Bedenken ernst. Nach Befragung von Experten forderte sie die Firma Roche auf, bis zum 13. März 2024 eine Ergänzung der Probandenaufklärung vorzunehmen. Dieser Absatz wurde eingefügt:
“Tominersen wurde seit 2015 in fünf verschiedenen klinischen Studien erprobt, darunter in einer großen Medikamentenprüfung der Phase-III namens GENERATION HD1, kurz GenHD1- Studie. In der GenHD1-Studie wurde Erwachsenen mit Huntington 120 mg Tominersen in zwei verschiedene Dosierhäufigkeiten (alle 2 Monate oder alle 4 Monate) verabreicht. Leider hat die GenHD1-Studie nicht die erhofften Ergebnisse erbracht. Die Gesamtergebnisse zeigten, dass Teilnehmer, welche Tominersen in der höheren Dosierhäufigkeit (also alle 2 Monate) erhielten, schlechtere Ergebnisse zeigten, als Teilnehmer, denen ein Scheinmedikament (Placebo) verabreicht wurde: mit einem Messwerkzeug für den klinischen Zustand, der cUHDRS (= zusammengesetzte vereinheitliche Beurteilungs-Skala für die Huntington-Krankheit) zeigte sich eine statistisch signifikante Verschlechterung der cUHDRS-Werte im Verlauf der Behandlung, was auf eine schnellere Progression der Huntington Krankheit hinweist. Bei den Teilnehmern, die 120 mg Tominersen nur alle 4 Monate erhielten, ähnelten die Ergebnisse dem Ergebnis der Gruppe, die das Placebo erhalten hatten.
Es wurde zudem eine dosisabhängige Vergrößerung der Nervenwasserflüssigkeits-gefüllten Hirnkammern (‚Seitenventrikel‘) beobachtet; als Messwert dafür wurde der prozentuale Anstieg der Größe der Seitenventrikel pro Jahr bestimmt („prozentuale, annualisierte Vergrößerung der Volumina der Seitenventrikel“). In Woche 69 der GenHD1-Studie nahm die Größe der Seitenventrikel in der Gruppe, die jeden zweiten Monat 120 mg Tominersen erhielt, um ~19 % zu. In der Gruppe, die die gleiche Menge Tominersen, aber nur alle vier Monate erhielt, nahm die Größe der Seitenventrikel um ~13 % zu, und in der Gruppe, die das Placebo erhielt, um ~9 %. Zusammenfassend lässt sich sagen, dass sich die Seitenventrikel pro Jahr im Vergleich zu Placebo um ~10 % (120 mg Tominersen in einer Dosierhäufigkeit alle 2 Monate) bzw. 5 % (Tominersen alle 4 Monate) vergrößerten. Diese Veränderungen der Größe der Seitenventrikel standen jedoch in keinem Zusammenhang mit Änderungen klinischer Messgrößen, weshalb ihre Bedeutung gegenwärtig ungeklärt ist. Auf Empfehlung externer, unabhängiger Experten wurde deshalb die Gabe der Studienmedikation in der GenHD1-Studie Ende März 2021 gestoppt. Die Empfehlung basierte auf einer Gesamtschau, in deren Rahmen der Nutzen und die Risiken einer Fortführung der Prüfung von Tominersen in diesen Dosierungen gegeneinander abgewogen wurden.
Nach dem Ende der GenHD1-Studie wiesen zusätzliche Analysen darauf hin, dass möglicherweise in einer Subgruppe (jüngere Teilnehmer, in früheren Stadien von Huntington, die Tominersen alle 4 Monate) im Vergleich zum Placebo günstigere Ergebnisse erzielt worden seien könnten.
Da diese Analysen im Nachhinein (‚post-hoc‘) durchgeführt wurden, können sie keine vor Beginn der Medikamentenprüfung formulierte Hypothese bestätigen, sind deshalb nicht beweisend und könnten einen Zufallsbefund darstellen. Die GENERATION HD2-Studie ist daher so angelegt, dass die Ergebnisse der Post-hoc-Analyse überprüft und möglicherweise bestätigt werden können. Die GENERATION HD2-Studie wird die Wirksamkeit und Sicherheit von Tominersen bei jüngeren erwachsenen Teilnehmern bewerten, die sich in den früheren Stadien der Huntington-Krankheit befinden, und die niedrigere Dosierung von Tominersen (100 mg und 60 mg alle 4 Monate) als in der GenHD1-Studie erhalten.“
Der in der Medizingeschichte bisher beispiellose Vorgang zeigt, dass der DHH-Vorstand die Belange der Huntington-Kranken sehr ernst nimmt. Insbesondere bei Medikamentenstudien hat für ihn die Sicherheit und umfassende Information der Studienteilnehmenden höchste Priorität.